Bệnh mốc sương cà chua hay còn gọi là bệnh sương mai, bệnh giám sương, bệnh dịch muộn… do nấm Phytophthora infestants gây ra, là một trong những bệnh gây hại nặng nhất đối với các vùng trồng cà chua trên thế giới. Việc kiểm soát bệnh mốc sương chủ yếu dựa vào việc sử dụng thuốc diệt nấm và các biện pháp canh tác. Tuy nhiên, hiệu quả của các biện pháp này không cao do sự biến đổi của các chủng Phytophthora infestants xuất hiện các chủng mới, và khả năng kháng thuốc diệt nấm của mầm bệnh tăng lên [1, 10]. Để phòng trừ bệnh này thì việc sử dụng giống kháng bệnh mang lại hiệu quả hơn cả, vừa tiết kiệm được chi phí, vừa an toàn với con người, vật nuôi và môi trường [8].
    |
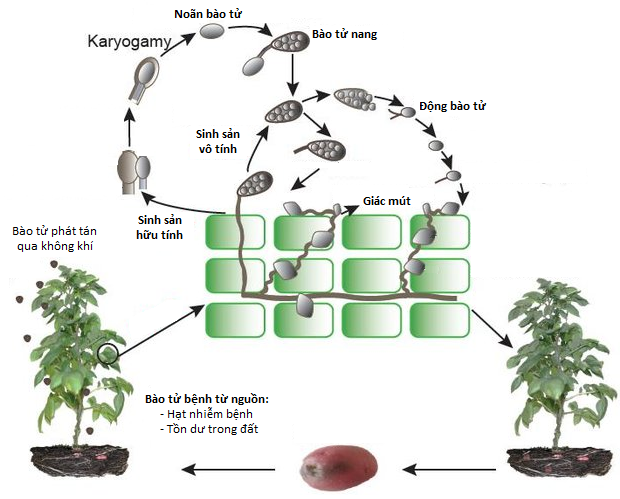 |
| Vòng đời của nấm mốc sương trên cây cà chua |
Muốn chọn tạo giống cà chua kháng bệnh mốc sương thành công việc đầu tiên phải xác định được số gen kháng và gen kháng hữu hiệu với các chủng phytophthora infestants. Đến nay, các nhà khoa học trên thế giới đã xác định được 6 gen kháng bệnh mốc sương khác nhau là: Gen Ph1 trên nhiễm sắc thể số 7, Ph2 trên nhiễm sắc thể số 10 [9, 13, 12], Ph3 trên nhiễm sắc thể số 9 [2], Ph4 trên nhiễm sắc thể số 2 [2] và Ph5-1, Ph5-2 trên nhiễm sắc thể số 1 và 10 [7]. Trong đó, các gen Ph1, Ph2 và Ph3 đã được sử dụng phổ biến để tạo ra các giống cà chua kháng. Tuy nhiên, gen Ph1 chỉ tạo được khả năng kháng hẹp với một vài chủng, trong khi đó gen Ph2 và Ph3 tạo ra mức độ kháng cao hơn. Gen Ph2 và Ph3 đã được đưa vào một số giống cà chua ăn tươi và chế biến [11]. Cùng với việc phát hiện ra các gen kháng, các nhà khoa học cũng đã nghiên cứu các chỉ thị phân tử DNA liên kết với các gen kháng. Tuy nhiên chưa có chỉ thị nào được công bố liên kết với gen Ph1, gen Ph2 và gen Ph3 có nhiều chỉ thị liên kết đã được công bố và sử dụng [4]. Điều này giúp cho việc phát hiện gen kháng Ph2, Ph3 phục vụ cho mục đích chọn tạo giống kháng thuận tiện và chính xác. Nắm bắt được tình hình trên, với mục đích tạo được nguồn vật liệu chọn giống cà chua kháng bệnh mốc sương đa dạng và phong phú, nhóm nghiên cứu của TS. Tống Văn Hải đã sử dụng chỉ thị UF-Ph2-1 phát hiện gen Ph2 [14], chỉ thị SCU602 phát hiện gen Ph3 [5] trong tập đoàn 230 mẫu giống cà chua được thu thập ở trong và ngoài nước. Tiếp đó đánh giá khả năng kháng của hai gen trên với một số isolate bệnh mốc sương bằng lây nhiễm nhân tạo. Kết quả thu được là đóng góp quan trọng góp phần phục vụ chương trình chọn tạo giống cà chua kháng bệnh mốc sương tại Việt Nam.
Kết quả xác định gen kháng Ph2
Gen Ph2 là gen trội nằm trên nhiễm sắc thể số 10, có rất nhiều chỉ thị phân tử liên kết với gen này được công bố như: Chỉ thị dTG63 [4] chỉ thị UF-Ph2-1 [14] …Trong nghiên cứu này chỉ thị UF-Ph2-1 đã được lựa chọn để phát hiện gen Ph2. Sản phẩm PCR sử dụng cặp mồi nhân chỉ thị UF-Ph2-1 có kích thước khoảng 500 bp ở cả những giống kháng và nhiễm. Sử dụng enzyme cắt giới hạn Hinf I cắt sản phẩm PCR trên mới có thể phân biệt được các trạng thái của các alen. Nếu là alen kháng (dạng đồng hợp tử trội) xuất hiện 3 vạch băng kích thước 355, 125 và 27 bp, nếu là alen nhiễm (đồng hợp tử lặn) xuất hiện 2 vạch băng kích thước 480 và 27 bp, nếu là alen dị hợp xuất hiện 4 vạch băng 480, 355, 125 và 27 bp. Tuy nhiên vạch băng 27 bp có kích thước nhỏ nên khi điện di chúng di chuyển ra khỏi bản gel nên không quan sát thấy (hình 1). Chỉ thị UF-Ph2-1 đã được Trần Ngọc Hùng & cs (2020) ứng dụng thành công trong việc chọn tạo giống cà chua kháng bệnh mốc sương. Điều tra 230 mẫu giống bằng chỉ thị UF-Ph2-1 phát hiện được được 11 mẫu giống mang gen kháng Ph2. Trong đó có một giống địa phương Việt Nam là cà chua Đá, 5 mẫu giống thu thập tại Viện nghiên cứu rau Châu Á là AVRDC113, AVRDC114, AVRDC150, AVRDC181 và AVRDC182, 3 mẫu giống của Mỹ là Us03, Us12 và Us13, 2 mẫu giống của Pháp là Fr20 và Fr23.
Kết quả xác định gen kháng Ph3
Gen Ph3 là gen trội nằm trên nhiễm sắc thể số 9, chỉ thị CCPB272-03740 là chỉ thị RAPD đầu tiên của gen Ph3 dựa trên phản ứng PCR và nằm cách gen kháng 5,8 cM. Tiếp theo Truong & cs (2013) đã phát triển chỉ thị đồng trội SCAR là SCU602 cho phép phát hiện dễ dàng các mẫu giống mang gen Ph3 cả ở dạng đồng hợp và dị hợp tử. Một nghiên cứu khác của Reza & cs (2015) đã chỉ ra 7 chỉ thị để phát hiện và chọn lọc gen kháng Ph3 là UF-Ph3-1; UF-Ph3-2; UF-Ph3-3; UF-Ph3-4; UF-Ph3-5; UF-Ph3-6 và UF-Ph3-7. Các chỉ thị này đều là các chỉ thị SCAR cho phép phân biệt các trạng thái alen khác nhau của gen Ph3 mà không cần sử dụng đến enzyme cắt giới hạn. Những chỉ thị này hoàn toàn có thể sử dụng trong nghiên cứu phát hiện và chọn lọc gen kháng Ph3. Để phát hiện gen kháng mốc sương Ph3, trong nghiên cứu này chỉ thị SCU602 đã được sử dụng. Cặp mồi SCU602F3/R3 nhân chỉ thị SCU602, với alen kháng, sản phẩm PCR có kích thước 400 bp và với alen mẫn cảm, sản phẩm PCR có kích thước 450 bp [5] (hình 2). Trong tổng số 230 mẫu giống được điều tra chúng tôi phát hiện được 17 mẫu mang gen kháng Ph3. Trong số đó có 11 mẫu giống thu thập tại Viện nghiên cứu rau Châu Á (AVRDC): AVRDC124, AVRDC125, AVRDC130, AVRDC131, AVRDC139, AVRDC140, AVRDC152, AVRDC157, AVRDC181, AVRDC182 và AVRDC198; 3 mẫu giống thu thu tại Pháp: Fr18, Fr23 và Fr33 và 3 mẫu giống thu thập tại Israel: Is04, Is05 và Is14.
Như vậy bằng chỉ thị phân tử DNA, 11 mẫu giống mang gen Ph2 và 17 mẫu giống mang gen Ph3 đã được phát hiện, danh sách các mẫu giống mang gen được tổng hợp ở bảng 1. Qua đó nhận thấy phần lớn các giống mang gen kháng Ph2 và Ph3 được thu thập từ Viện nghiên cứu rau châu Á. Các giống còn lại được thu thập tại Pháp, Mỹ và Israel. Đặc biệt trong số đó có 03 mẫu giống mang đồng thời 2 gen là AVRDC181, AVRDC182 và Fr23. Ở Việt Nam phát hiện duy nhất 01 giống mang gen kháng Ph2 là Cà chua Đá. Đây là nguồn gen vô cùng quý giá phục vụ các chương trình chọn tạo giống cà chua kháng bệnh mốc sương.
Bảng 1. Danh sách các mẫu giống chứa gen kháng Ph2 và Ph3
|
STT
|
Ký hiệu
|
Chứa gen
|
Nguồn gốc
|
|
1
|
AVRDC113
|
Ph2
|
Viện nghiên cứu rau Châu á
|
|
2
|
AVRDC114
|
Ph2
|
Viện nghiên cứu rau Châu á
|
|
3
|
AVRDC124
|
Ph3
|
Viện nghiên cứu rau Châu á
|
|
4
|
AVRDC125
|
Ph3
|
Viện nghiên cứu rau Châu á
|
|
5
|
AVRDC130
|
Ph3
|
Viện nghiên cứu rau Châu á
|
|
6
|
AVRDC131
|
Ph3
|
Viện nghiên cứu rau Châu á
|
|
7
|
AVRDC139
|
Ph3
|
Viện nghiên cứu rau Châu á
|
|
8
|
AVRDC140
|
Ph3
|
Viện nghiên cứu rau Châu á
|
|
9
|
AVRDC150
|
Ph2
|
Viện nghiên cứu rau Châu á
|
|
10
|
AVRDC152
|
Ph3
|
Viện nghiên cứu rau Châu á
|
|
11
|
AVRDC157
|
Ph3
|
Viện nghiên cứu rau Châu á
|
|
12
|
AVRDC181
|
Ph2, Ph3
|
Viện nghiên cứu rau Châu á
|
|
13
|
AVRDC182
|
Ph2, Ph3
|
Viện nghiên cứu rau Châu á
|
|
14
|
AVRDC198
|
Ph3
|
Viện nghiên cứu rau Châu á
|
|
15
|
Fr18
|
Ph3
|
Université Picardie et Jules Verne Amiens (Pháp)
|
|
16
|
Fr20
|
Ph2
|
Université Picardie et Jules Verne Amiens (Pháp)
|
|
17
|
Fr23
|
Ph2, Ph3
|
Université Picardie et Jules Verne Amiens (Pháp)
|
|
18
|
Fr33
|
Ph3
|
Université Picardie et Jules Verne Amiens (Pháp)
|
|
19
|
Us03
|
Ph2
|
University of California, Davis (Mỹ)
|
|
20
|
Us12
|
Ph2
|
University of San Carlos, Guatemala (Mỹ)
|
|
21
|
Us13
|
Ph2
|
University of San Carlos, Guatemala (Mỹ)
|
|
22
|
Is02
|
Ph3
|
Trường Đại Học Ben Gurion’s, Iserel
|
|
24
|
Is12
|
Ph3
|
Trường Đại Học Ben Gurion’s, Iserel
|
|
24
|
Is14
|
Ph3
|
Trường Đại Học Ben Gurion’s, Iserel
|
|
25
|
Cà chua Đá
|
Ph2
|
Trung tâm Bảo tồn và PT Nguồn gen Cây trồng
|
Lây nhiễm nhân tạo xác định khả năng kháng của gen Ph2 và Ph3
Đánh giá khả năng kháng bệnh của các mẫu giống mang gen Ph2 và Ph3 bằng lây nhiễm nhân tạo 6 isolate nấm bệnh mốc sương thu thập tại Hà Nội, Sơn La, Hải Dương, Thái Bình, Hải Phòng và Thanh Hoá theo phương pháp của Nelson (2006). Sau 6 ngày tiến hành đánh giá mức độ kháng nhiễm của từng mẫu giống. Đối với mẫu giống đối chứng PT18 nhận thấy chúng bị nhiễm với tất cả các isolate, nhiễm rất nặng đối với isolate thu thập tại Hải Dương, Sơn La và Thanh hoá (bảng 2). Điều này chứng tỏ cả 6 isolate sử dụng lây nhiễm nhân tạo đều có độc tính cao. Qua bảng 2 nhận thấy tất cả các mẫu giống mang gen Ph2 kháng cao (HR) đối với isolate thu thập tại Thái Bình và Hải Phòng, kháng (R) với isolate thu thập tại Hải Dương. Nhiễm (S) đối với isolate thu thập tại Hà Nội, Sơn La và Thanh Hoá. Các mẫu giống mang gen Ph3 kháng cao (HR) đối với isolate thu thập tại Sơn La và Thanh Hoá, kháng (R) đối với 3 isolate thu thập tại Hà Nội, Thái Bình, Hải Phòng và nhiễm (S) với isolate thu thập tại Hải Dương. Như vậy gen Ph3 có khả năng kháng tốt hơn gen Ph2. Một điều đặc biệt là các mẫu giống mang đồng thời hai gen kháng thì chúng bổ sung cho nhau, kháng được tất cả các isolate lây nhiễm. Để chọn tạo giống cà chua kháng tốt với bệnh mốc sương miền Bắc Việt Nam thì ta nên sử dụng đồng thời hai gen nói trên. Kết quả nghiên cứu này cũng tương tự kết quả nghiên cứu của Trần Ngọc Hùng & cs (2020) khi nghiên cứu chọn tạo giống cà chua kháng bệnh mốc sương với gen Ph2 và Ph3. Tác giả cũng có kết luận dòng mang hai gen kháng Ph2 và Ph3 cho khả năng kháng tốt hơn là dòng chỉ mang một gen và gen Ph3 thể hiện tính kháng ổn định với tất cả các mẫu nấm lây nhiễm. Một câu hỏi đặt ra là các mẫu nấm bệnh mà tác giả Trần Ngọc Hùng & cs (2020) lây nhiễm giống hay khác với 6 isolate nấm trong nghiên cứu này. Nếu chúng khác nhau thì gen Ph2 và Ph3 có phổ kháng rất rộng đối với các isolate bệnh mốc sương của Việt Nam, và hai gen này càng trở nên ý nghĩa hơn cho các nhà chọn tạo giống sử dụng để lai tạo. Trong nghiên cứu này chúng tôi nhận thấy phản ứng của hai gen kháng Ph2 và Ph3 giống hệt nhau đối với hai cặp isolate bệnh mốc sương thu tại Thái Bình - Hải Phòng và Sơn La - Thanh Hoá. Theo chúng tôi có thể isolate thu thập tại Thái Bình và Hải phòng là giống nhau và mẫu thu thập tại Sơn La và Thanh Hoá là cùng một isolate. Cần có một nghiên cứu tiếp theo sâu hơn về thành phần các chủng sinh lý nấm bệnh mốc sương ở Việt Nam để phục vụ công tác đánh giá nhân tạo các gen kháng một cách chính xác hơn.
Bảng 2. Kết quả đánh giá khả năng kháng bệnh mốc sương của các gen
|
Ký hiệu
|
Chứa gen
|
Điểm kháng sau 6 ngày lây nhiễm
|
|
|
|
Isolate
Hà Nội
|
Isolate
Hải Dương
|
Isolate
Thái Bình
|
Isolate Hải phòng
|
Isolate
Sơn La
|
Isolate Thanh Hoá
|
|
AVRDC113
|
Ph2
|
S
|
R
|
MR
|
MR
|
S
|
S
|
|
AVRDC114
|
Ph2
|
S
|
R
|
MR
|
MR
|
S
|
S
|
|
AVRDC124
|
Ph3
|
R
|
S
|
R
|
R
|
MR
|
MR
|
|
AVRDC125
|
Ph3
|
R
|
S
|
R
|
R
|
MR
|
MR
|
|
AVRDC130
|
Ph3
|
R
|
S
|
R
|
R
|
MR
|
MR
|
|
AVRDC131
|
Ph3
|
R
|
S
|
R
|
R
|
MR
|
MR
|
|
AVRDC139
|
Ph3
|
R
|
S
|
R
|
R
|
MR
|
MR
|
|
AVRDC140
|
Ph3
|
R
|
S
|
R
|
R
|
MR
|
MR
|
|
AVRDC150
|
Ph2
|
S
|
R
|
MR
|
MR
|
S
|
S
|
|
AVRDC152
|
Ph3
|
R
|
S
|
R
|
R
|
MR
|
R
|
|
AVRDC157
|
Ph3
|
R
|
S
|
R
|
R
|
MR
|
MR
|
|
AVRDC181
|
Ph2, Ph3
|
R
|
R
|
R
|
R
|
MR
|
MR
|
|
AVRDC182
|
Ph2, Ph3
|
R
|
R
|
R
|
R
|
MR
|
MR
|
|
AVRDC198
|
Ph3
|
R
|
S
|
R
|
R
|
MR
|
MR
|
|
Fr18
|
Ph3
|
R
|
S
|
R
|
R
|
MR
|
MR
|
|
Fr20
|
Ph2
|
S
|
R
|
MR
|
MR
|
S
|
S
|
|
Fr23
|
Ph2, Ph3
|
R
|
R
|
R
|
R
|
MR
|
MR
|
|
Fr33
|
Ph3
|
R
|
S
|
R
|
R
|
MR
|
MR
|
|
Us03
|
Ph2
|
S
|
R
|
MR
|
MR
|
S
|
S
|
|
Us12
|
Ph2
|
S
|
R
|
MR
|
MR
|
S
|
S
|
|
Us13
|
Ph2
|
S
|
R
|
MR
|
MR
|
S
|
S
|
|
Is04
|
Ph3
|
R
|
S
|
R
|
R
|
MR
|
MR
|
|
Is05
|
Ph3
|
R
|
S
|
R
|
R
|
MR
|
MR
|
|
Is14
|
Ph3
|
R
|
S
|
R
|
R
|
MR
|
MR
|
|
Cà chua Đá
|
Ph2
|
S
|
R
|
R
|
R
|
S
|
S
|
|
PT18
|
-
|
S
|
HS
|
S
|
S
|
HS
|
HS
|
Kết luận
Bằng việc sử dụng các chỉ thị phân tử DNA đã phát hiện được 11 mẫu giống mang gen kháng Ph2, 17 mẫu giống mang gen kháng Ph3, 3 mẫu giống mang đồng thời 2 gen Ph2 và Ph3. Kết quả lây nhiễm nhân tạo 6 isolate bệnh mốc sương xác định được gen Ph3 kháng được 5/6 isolate, gen Ph2 được 3/6 isolate. Đặc biệt các mẫu giống mang đồng thời 2 gen kháng thì kháng được tất cả các isolate lây nhiễm.
TÀI LIỆU THAM KHẢO
[1] A. Saville, K. Graham, N.J. Grünwald, K. Myers, W.E. Fry, J.B. Ristaino, “Fungicide sensitivity of US genotypes of Phytophthora infestans to six oomycete targeted compounds” Plant Dis, Vol. 99, pp.659-666, 2015.
[2] C. Zhang, L. Liu, X. Wang, J. Vossen, G. Li, T. Li, Z. Zheng, J. Gao, Y. Guo, R.G. Visser, J. Li, Y. Bai, Y. Du, “The Ph-3 gene from Solanum pimpinellifolium encodes CC-NBS-LRR protein conferring resistance to Phytophthora infestans”, Theor Appl Genet Vol. 127, pp. 1353-1364, 2014.
[3] C.Kole, H. Ashrafi, G. Lin, M. Foolad, “Identification and molecular mapping of a new R gene, Ph-4, conferring resistance to late blight in tomato”, Solanaceae Conference, University of Wisconsin, Madison, Abstract, pp. 449, 2006.
[4] D.R Panthee and M.R Foolad, “A reexamination of molecular markers for use in marker-assisted breeding in tomato”. Euphytica, Vol.184, pp. 165-179, 2012.
[5] H. H. T. Truong, N.H. Tran, H.S. Choi, P.H. Park and H.E. Lee, H. E, Development of a co-dominant SCAR marker linked to the Ph3 gene for Phytophthora infestans resistance in tomato (Solanum lycopersicum). Eur. J. Plant Pathol, Vol.136, pp. 237-245, 2013.
[6] H.E. Nelson, “Bioasay to detect small differences in resistance of tomato to late blight according to leaf age, leaf and leaflet position, and plant age. Australasian Plant Pathology, Vol.35, pp. 297- 301, 2006.
[7] H.L. Merk, H. Ashrafi, M.R. Foolad, “Selective genotyping toidentify late blight resistance gens in an accession of the tomato wild species Solanum pimpinellifolium”, Euphytica, Vol. 187, pp.63-75, 2012
[8] J. Bonnet, S. Danan, C. Boudet, L.P.Barchi, B. Caromel, A. Palloix, V. Lefebvre, “Are the polygenic architectures of resistance to Phytophthora capsici and P. parasitica independent in pepper”. Theoretical and Applied Genetics; Heidelberg Vol. 115, Iss. 2, pp. 253-64, 2007.
[9] L.C. Peirce, “Linkage tests with Ph conditioning resistance to race 0, Phytophthora infestans”, Report of the Tomato Genetics Cooperative, pp. 21-30, 1971.
[10] M.S. Montes, B. Nielsen, S. Schmidt, L.Bodker, R. Kjoller, S. Rosendahl, “Population gentics of Phytophthora infestans in Denmark reveals dominantly clonal populations and specific alleles linked to metalaxyl-M resistance”, Plant Pathol, Vol. 65, pp.744-753, 2016.
[11] M.D.Robbins, M.A. Masud, D.R. Panthee, R.G. Gardner, D.M. Francis, M.R. Stevens, “Marker-assisted selection for coupling phase resistance to tomato spotted wilt virus and Phytophthora infestans (late blight) in tomato”. HortScience, Vol.45(10), pp.1424-1428, 2010.
[12] M.R.Foolad, H. Merk, H. Ashrafi, “Gentics, genomics and breeding of late blight and early blight resistance in tomato”,
Critical Reviews in Plant Sciences, Vol.27, pp.75-107, 2008.
[13] P. Moreau, P. Thoquet, J. Olivier, H. Laterrot, N. Grimsley, “Genetic mapping of Ph2, a single locus controlling partial resistance to Phytophthora infestans in tomato”, Molecular Plant-Microbe Interact, Vol. 11, pp. 259-268, 1998.
[14] S. Reza, F. Samuel, Hutton & W.J. Scott, “Designing new DNA markers and determining the effective size of Ph2 and Ph3 introgressions for late blight resistance stacking purposes in tomato”, TGC Report, Vol. 65, pp. 22-31, 2015.
[15] S. Sobkowiak and J. Śliwka, “Phytophthora infestans: isolation of pure cultures, storage and inoculum preparation”, Plant breeding and seed science, Vol. 76, pp. 9-15, 2017.
[16] Trần Ngọc Hùng, Vũ Thị Thu Hiền, “Quy tụ gen Ph2 và Ph3 trong chọn tạo giống cà chua kháng bệnh sương mai” Tạp chí Khoa học và Công nghệ Nông nghiệp Việt Nam, Số 11, Tr. 48-54, 2020.