1. GIỚI THIỆU VỀ HỢP CHẤT LUTEOLIN
Luteolin (Lut) là một trong những flavonoid phổ biến nhất, có tên khoa học là 3’,4’,5,7-tretrahydroxyflavonone. Công thức phân tử của Lut là C15H10O6 và cấu trúc được thể hiện trong hình 1 [1]. Phân tử Lut trong thực vật phân bố rộng rãi dưới dạng phân tử aglycone không có phần đường và dưới dạng phân tử glycoside có phần đường liên kết với nó. Luteolin có tính chất hòa tan trong nước yếu [2]. Hầu hết các phân tử Lut tồn tại dưới dạng O-glycoside, có aglycone liên kết với phần đường bằng một hoặc nhiều nhóm hydroxyl (OH). Các nhóm OH nằm ở vị trí 5, 7, 3′ và 4′. Trong số các phần đường, glucose là phân tử đường chính liên kết với luteolin. Ngoài ra, rhamnose, rutinose, arabinose, xylose và axit glucuronic là các dẫn xuất đường khác [3,4].
    |
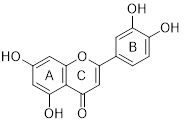 |
| Hình 1: Cấu trúc cơ bản của luteolin |
Luteolin được sinh tổng hợp thông qua con đường phenylpropanoid. Con đường phenylpropanoid bắt đầu bằng phenylalanine-sản phẩm cuối cùng của con đường shikimate. Con đường phenylpropanoid tạo ra sự đa dạng của các hợp chất là flavonoid, tannin và lignin [5]. Nhờ 6 bước xúc tác enzyme trong quá trình sinh tổng hợp phenylproponoid tạo thành luteolin (Hình 2). Bước đầu tiên là xúc tác quá trình chuyển hóa phenylalanine thành cinnamic acid nhờ enzyme phenylalanine amoniac-lyase (PAL). Phenylalanine được khử amin thành cinnamic acid và amoniac. Ở giai đoạn thứ hai, cinnamate 4-hydroxylase (C4H) xúc tác cho quá trình chuyển hóa cinnamic acid thành p-coumarate. Sau đó, p-coumarate được chuyển hóa thành p-coumaroyl CoA thông qua enzyme 4-coumarate CoA-ligase (4CL) [6]. Sau đó được chuyển đổi thành naringenin chalcone (NC) bởi enzyme chalcone synthase (CHS), một enzyme họ polyketide synthase loại III [7]. NC được chuyển đổi thành naringenin, một hợp chất quan trọng đóng vai trò là bước chính trong quá trình sinh tổng hợp luteolin bởi enzyme chalcone isomerase (CHI) [8]. Hơn nữa, naringenin được chuyển thành eriodictyol bởi enzyme flavonoid 3’-hydroxylase (F3’H), vì enzyme này đưa một nhóm hydroxyl vào vị trí 3’ trong vòng beta [9]. Ngoài ra, flavone synthase (FNS) thuộc họ cytochrome P450, tạo thành Lut từ tiền chất naringenin và eriodictyol [10, 11].
    |
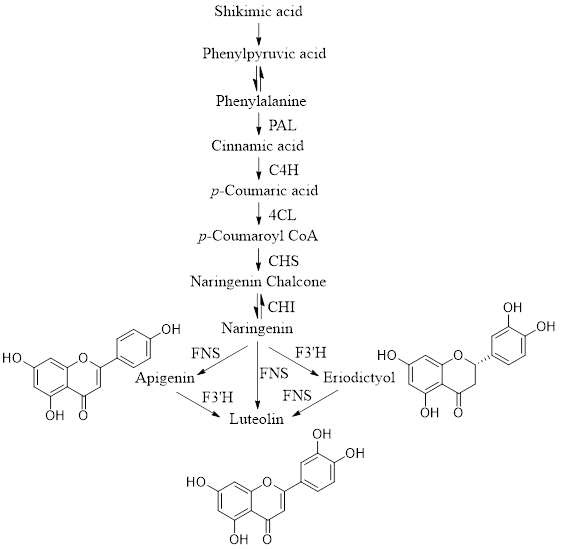 |
| Hình 2: Mô tả ngắn gọn con đường sinh tổng hợp luteolin |
Luteolin là một trong những chất hóa học thực vật thiết yếu trong thực phẩm có trong nhiều loại rau như bông cải xanh, cần tây, lá hành, rau mùi tây, cà rốt, bắp cải, ớt và hoa cúc. Ví dụ, trong các loại trái cây, vỏ táo được coi là nguồn giàu Lut [12]. Các loại cây có nhiều Lut được sử dụng rộng rãi trong sản xuất các loại thuốc truyền thống của Trung Quốc để điều trị các bệnh viêm, ung thư và tăng huyết áp [13]. Nó chủ yếu được tìm thấy trong một loạt các loại rau. Rau diếp xoăn có hàm lượng luteolin nổi bật với 37,96 mg/100 g, tiếp theo là cần tây sống (cần tây Trung Quốc) có 34,87 mg/100 g luteolin. Trong số các loại thảo mộc, cây kinh giới cay với hàm lượng Lut cao nhất là 1028,75 mg/100 g. Trong trường hợp của trái cây và thực vật, chanh không có vỏ và cây xô thơm tươi là nguồn luteolin tốt với lần lượt là 1,50 và 16,70 mg/100 g [14]…
2. MỘT SỐ HOẠT TÍNH SINH HỌC CỦA NARINGIN
Nhiều loại rau, trái cây và thảo mộc như cà rốt, bắp cải, atisô, trà, cần tây và táo rất giàu Lut. Lượng Lut trung bình hấp thụ là 0,01–0,20 mg/ngày (0,0349–0,698 mmol/ngày) [15] (Wang và cộng sự, 2009). Lut được hấp thụ bởi niêm mạc ruột. Sau khi uống 14,3 mg/kg Lut, nồng độ tối đa trong huyết tương là 1,97 ± 0,15g/ml. Thời gian đạt được nồng độ tối đa là 1,02 ± 0,22 giờ và thời gian bán hủy của Lut là 4,94 ± 1,2 giờ. Thông qua các con đường truyền tín hiệu nội tại và ngoại tại, Lut là một hợp chất hoạt động có hoạt tính chống oxy hóa, chống khối u, chống viêm và chống chết tế bào theo chương trình (apoptosis) [16, 17] (Sun và cộng sự, 2015; Zhang và cộng sự, 2016). Một số hoạt tính sinh học của Lut được giới thiệu dưới thiệu dưới đây.
2.1. Hoạt tính kháng oxi hóa
Phân tử LUT trong số các flavonoid có hoạt tính chống oxy hóa vì nó sở hữu hoạt tính chống dọn rác do nhóm glycosidic của nó, giúp loại bỏ các loài nitơ phản ứng và các loài oxy [25–29]. Hoạt tính chống oxy hóa của LUT có liên quan đến hiệu ứng C-glycosyl hóa ở nhiều vị trí khác nhau, gây ra cường độ và những thay đổi trong đặc tính dọn rác của nó [30]. Tiền xử lý bằng luteolin (50 mg/kg uống) giúp bảo vệ chống lại suy thận thông qua cơ chế giải độc bằng hoạt động chống oxy hóa và cơ chế chống viêm và chống apoptosis ở chuột Wister [31]. Ngoài ra, LUT giúp làm giảm tác động của tổn thương niêm mạc do viêm niêm mạc ruột trong quá trình điều trị ung thư [32]. Độc tính gan do carbon tetra clorua (CCl4) gây ra ở mô hình chuột đã được giảm nhờ đặc tính chống oxy hóa của LUT bằng cách tăng hoạt động của nhiều loại enzyme chống oxy hóa [33]. Hơn nữa, hoạt động chống oxy hóa LUT đã được chứng minh là gây ra apoptosis thông qua việc tăng hoạt động chống oxy hóa [34]. LUT từ Reseda odorata L. làm giảm viêm tụy cấp tính nặng (SAP) bằng cách kích hoạt hoạt động chống viêm và chống oxy hóa dựa trên hemeoxygenase-1 (HO−1) thông qua việc ức chế yếu tố hạt nhân-κB (NF-κB) [35]. LUT cũng hoạt động như một phân tử bảo vệ hóa học trong quá trình điều trị bằng doxorubicin gây ra tổn thương gan thận, vì nó giúp tăng hiệu quả điều trị của thuốc bằng cách loại bỏ tác dụng độc hại của thuốc do bản chất chống oxy hóa của nó [36]. Do đó, vai trò hiệu quả của phân tử LUT và các glycoside của nó làm trung gian cho một hành động quan trọng trong các quá trình trao đổi chất khác nhau và hoạt động như một phân tử bảo vệ bằng cách giảm các loài ROS thông qua hoạt động chống oxy hóa của nó.
2.2. Hoạt tính ức chế ung thư
Ung thư là căn bệnh gây tử vong nhiều nhất cho con người, vì tỷ lệ tử vong trên toàn cầu ngày càng tăng do bản chất không thể chữa khỏi của nó. Vì riêng căn bệnh này đã gây ra khoảng 10 triệu ca tử vong, điều này ngụ ý rằng cứ sáu người thì có một người tử vong vì nó [37]. Các loại ung thư phổ biến nhất là ung thư phổi, vú, ruột kết, tuyến tiền liệt, dạ dày, gan, buồng trứng, tuyến giáp và trực tràng. Nguyên nhân khiến tỷ lệ ung thư xuất hiện nhiều hơn là do những thay đổi về lối sống như tăng tiêu thụ thuốc lá và rượu, chỉ số cân nặng cơ thể tăng cao, thiếu vận động thể chất và lượng thức ăn nạp vào cơ thể thấp hơn. Các bệnh liên quan như vi-rút papilloma ở người (HPV) gây ra gần 30% số ca tử vong do ung thư [38–40]. Phân tử luteolin có đặc tính chống ung thư và chống viêm [41] (Hình 4 và Bảng 1). Phân tích in silico phân tử LUT từ Tridax procumbens cho thấy nó có khả năng hoạt động cao và ít độc tính với tim hơn, khiến nó trở thành ứng cử viên thuốc lý tưởng nhắm vào protein duy trì nhiễm sắc thể nhỏ (MCM7) gây ra rối loạn điều hòa DNA và dẫn đến nhiều loại ung thư khác nhau [42]. Phân tử LUT có đặc tính chống ung thư do hoạt động chống oxy hóa và dập tắt gốc tự do của nó [41]. Hoạt động ức chế hiệu quả của nó đối với sự tăng sinh tế bào ung thư được nghiên cứu cả trong cơ thể sống với liều lượng từ 3 đến 50 µM và trong ống nghiệm với liều lượng từ 5 đến 10 mg/kg đã chứng minh hiệu quả của nó [43]. Khả năng thâm nhập vào da của nó mang lại lợi thế trong việc điều trị ung thư da. Các nghiên cứu liên quan đến tế bào ung thư biểu mô ở người đã chỉ ra hoạt động của nó chống lại ung thư dạ dày ở giá trị IC50 là 7,1 µg/mL. Đối với ung thư phổi, hoạt động hiệu quả của nó được thấy ở giá trị IC50 là 11,7 µg/mL và giá trị IC50 là 19,5 µg/mL được phát hiện có hiệu quả chống lại ung thư bàng quang [44]. Ung thư máu bạch cầu là một loại ung thư lớn khác ảnh hưởng đến con người, vì nó sản sinh ra các tế bào bạch cầu bất thường, gây ra nhiều ca tử vong.
Hợp chất LUT cũng cho thấy tác dụng ức chế đối với các dòng tế bào bạch cầu ở người CEM-C1 và CEM-C7 [45,46]. Ngoài ra, tác dụng ức chế tăng trưởng của nó được chứng minh trong một nghiên cứu chống lại HL-60, các tế bào bạch cầu tiền tủy bào ở người. LUT từ quả Vitex rotundifolia có nồng độ ức chế tăng trưởng là 15 µM sau 96 giờ [47,48]. Ngoài ra, khi các mô hình chuột mắc bệnh tiểu đường do STZ gây ra được dùng luteolin, nó cải thiện chức năng nhận thức, vì nó làm giảm tình trạng bệnh tiểu đường. Sự cải thiện trong biểu hiện của protein liên quan đến tăng trưởng-43 (GAP-43) và synaptophysin (SYN) ở hồi hải mã sau khi điều trị bằng LUT cũng được tìm thấy [49].
2.3. Hoạt tính chống tiểu đường
Bệnh tiểu đường là mối quan tâm đáng kể về sức khỏe trên toàn thế giới. Bệnh này phổ biến ở mọi quốc gia phát triển và đang phát triển. Theo báo cáo năm 2017 của Liên đoàn tiểu đường quốc tế (IDF), gần 451 triệu người bị ảnh hưởng bởi căn bệnh này, dự kiến con số này sẽ tăng lên 693 triệu vào năm 2045. Bệnh cũng gây ra những tác động nghiêm trọng về kinh tế xã hội. Bệnh tiểu đường ở nhóm dân số trẻ đang gia tăng, điều này khiến xã hội lo ngại. Bệnh tiểu đường là một trong những căn bệnh hàng đầu ảnh hưởng đến sức khỏe của dân số thế giới và dẫn đến nhiều căn bệnh đe dọa tính mạng [68].
LUT, một chất chuyển hóa thực vật thứ cấp, có đặc tính chống tiểu đường, như đã được xác lập trong nhiều nghiên cứu. Khi dùng, nó làm giảm ngưỡng co giật do hoạt động chống động kinh của nó. Ngoài ra, đặc tính bảo vệ thần kinh của nó giúp làm giảm tình trạng chết tế bào thần kinh do axit kainic gây ra ở vùng CA3 của hồi hải mã. Khi được sử dụng như tiền xử lý, nó bảo vệ hình thái của nhân tế bào thần kinh, ty thể và lưới nội chất, đồng thời phục hồi cấu trúc siêu nhỏ của tế bào thần kinh [69]. Bệnh tiểu đường ảnh hưởng đến cơ tim và gây ra I/R cơ tim hoặc tổn thương do stress oxy hóa. Khi được điều trị bằng LUT, stress oxy hóa và tổn thương tim sẽ giảm đi nhờ sự chuyển hướng trong phản ứng oxy hóa thông qua việc kích hoạt vòng phản hồi dựa trên sestrin 2-Nrf2 [70]. Bệnh tiểu đường lâu dài ảnh hưởng đến các tế bào thần kinh vỏ não; việc sử dụng luteolin làm giảm đáng kể các tình trạng bệnh tiểu đường, bao gồm cả peroxy hóa lipid, vì nó làm tăng trong não chuột mắc bệnh tiểu đường và cũng làm giảm hoạt động của GS4, superoxide dismutase và catalase, những hoạt động này giảm đáng kể ở vỏ não và hồi hải mã của chuột khi sử dụng luteolin. Điều này ngụ ý rằng tác dụng chống oxy hóa của luteolin giúp cải thiện tế bào thần kinh CA1 bằng cách giảm apoptosis tế bào thần kinh, vì hoạt động ChE là kết quả của bệnh tiểu đường, dẫn đến suy giảm nhận thức tiến triển và rối loạn chức năng thần kinh. Khi điều trị cho chuột mắc bệnh tiểu đường bằng LUT, hoạt động ChE bị ức chế, do đó cải thiện tình trạng bệnh [71]. Một nghiên cứu ghép nối phân tử in silico cho thấy LUT liên kết hiệu quả với alpha-amylase và dipeptidyl peptidase IV (DPP IV). Do đó, nó ngăn chặn quá trình tối ưu hóa glucose và sau đó liên kết với glutamine-fructose-6-phosphate amido transferase (GFAT1) và protein hộp Forkhead O1 (FOX01), cho thấy rằng nó có thể giúp tránh tăng đường huyết. Điều này cho thấy LUT là chất ức chế mạnh bệnh đái tháo đường týp 2 [72]. Trong quá trình xuất huyết thận, LUT làm giảm đáng kể nồng độ MDA và tăng hoạt động SOD. Nó cũng phục hồi mức lipid huyết thanh tăng cường ở bệnh đái tháo đường, vì mức tăng dẫn đến bệnh thận đái tháo đường. Các đặc tính chống oxy hóa của nó giúp giảm stress oxy hóa bằng cách ổn định lipid màng và do đó làm giảm tổn thương oxy hóa. Tác dụng bảo vệ thận của Luteolin liên quan đến việc tăng cường biểu hiện HO-1 và tạo ra chất chống oxy hóa trong bệnh thận đái tháo đường.
Luteolin ngăn ngừa tổn thương hình thái của thận do bệnh đái tháo đường gây ra [21]. Tuy nhiên, cần có nghiên cứu chuyên sâu để kiểm tra cơ chế tác dụng bảo vệ thận của luteolin. Trong một nghiên cứu khác, so với các tế bào không được điều trị, LUT làm tăng đáng kể biểu hiện PI3K và IRS1/2 theo cách phụ thuộc vào liều lượng. Những phát hiện này chứng minh rằng trong các tế bào mỡ, độ nhạy insulin phụ thuộc vào con đường IRSI 1/2 và PI3K đã được nhìn thấy. Thực tế là LUT ngăn p65 di chuyển từ tế bào chất vào nhân cho thấy nó làm giảm tình trạng viêm của tế bào mỡ bằng cách ngăn chặn hoạt hóa tế bào NK-кB [73].
Luteolin là chất ức chế không cạnh tranh của alpha-glucosidase, vì nó liên kết với các enzyme, dù ở nồng độ thấp hay cao. Điều này cho thấy LUT có ái lực mạnh nhất đối với các enzyme alpha-glucosidase và BACE1 [74]. Luteolin hoạt động như một chất ức chế mạnh, có hiệu quả cao, không cạnh tranh và có thể đảo ngược của alpha-glucosidase [75]. Do IC50 thấp, LUT thể hiện hoạt động ức chế dipeptidyl peptidase IV (DPP IV) mạnh nhất. Một nghiên cứu động học cho thấy LUT ức chế DPP IV theo cách không cạnh tranh và liên kết với protein S3 và S2. Chuỗi bên của các gốc axit amin có thể thay đổi trong xác nhận DPP IV do liên kết S2 và S3. IC của DPP IV là cần thiết để ức chế 50% hoạt động của enzyme [76].
2.4. Hoạt tính chống viêm
Viêm là phản ứng với các kích thích do tế bào miễn dịch và tế bào không miễn dịch trong cơ thể chúng ta gây ra bằng cách liên quan đến nhiều con đường sinh hóa và các phân tử khác nhau. Đây là quá trình tự nhiên về cách cơ thể phản ứng với kích thích với sự trợ giúp của các tế bào miễn dịch như tế bào tiêu diệt tự nhiên, đại thực bào và các con đường phân tử của chúng. Tuy nhiên, phản ứng viêm là cần thiết để giảm tác động của các kích thích, ảnh hưởng thêm đến các tế bào bình thường, nhưng tình trạng viêm kéo dài ảnh hưởng đến hoạt động bình thường vì nó dẫn đến các tình trạng mãn tính, do đó cần phải ngăn ngừa. Để kiểm soát tình trạng này, các phân tử chống viêm được sử dụng để bảo vệ tế bào khỏi các tác dụng phụ [77]. Luteolin có đặc tính chống viêm, được thể hiện trong Hình 5. Luteolin làm giảm tình trạng viêm do oxLDL kích hoạt bằng cách ức chế một chất chuyển tín hiệu và chất kích hoạt phiên mã 3 (STAT3) trong ống nghiệm. Một nghiên cứu cho thấy sự tương tác của nó với STAT3 chủ yếu thông qua liên kết hydro [78]. Việc sử dụng luteolin làm giảm tổn thương phổi bằng cách làm giảm pyroptosis dựa trên caspase-2 trong mô phổi của thủ thuật thắt và chọc manh tràng (CLP). Trong mô hình chuột ALI được tạo ra, nó cũng điều chỉnh cơ chế liên quan đến tần suất tế bào T được điều chỉnh (Treg) và IL-10 có nguồn gốc từ Treg [79].
Tài liệu tham khảo
[1] Weng, C. J., and Yen, G. C. (2012). Flavonoids, a ubiquitous dietary phenolic subclass, exert extensive in vitro anti-invasive and in vivo anti-metastatic activities. Cancer Metastasis Rev. 31, 323–351.
[2] Shakeel, F.; Haq, N.; Alshehri, S.; Ibrahim, M.A.; Elzayat, E.M.; Altamimi, M.A.; Mohsin, K.; Alanazi, F.K.; Alsarra, I.A., (2018). Solubility, Thermodynamic Properties and Solute-Solvent Molecular Interactions of Luteolin in Various Pure Solvents. J. Mol. Liq. 255, 43–50.
[3] Wang, Z.; Zeng, M.; Wang, Z.; Qin, F.; Chen, J.; He, Z., (2021). Dietary Luteolin: A Narrative Review Focusing on Its Pharmacokinetic Properties and Effects on Glycolipid Metabolism. J. Agric. Food Chem. 69, 1441–1454.
[4] Lopez-Lazaro, M., (2009). Distribution and Biological Activities of the Flavonoid Luteolin. Mini-Rev. Med. Chem, 9, 31–59.
[5] Guleria P, Kumar V., (2017). Understanding the phenylpropanoid pathway for agronomical and nutritional improvement of mungbean. J Hortic Sci Biotechnol; 92:335-48.
[6] Wang C, Zhi S, Liu C, Xu F, Zhao A, Wang X, et al., (2016). Characterization and functional analysis of 4-coumarate:coa ligase genes in mulberry. PLoS One; 11:e0155814.
[7] Noel, J.P.; Ferrer, J.-L.; Jez, J.M.; Bowman, M.E.; Dixon, R.A., (1999). Structure of Chalcone Synthase and the Molecular Basis of Plant Polyketide Biosynthesis. Nat. Struct. Biol. 6, 775–784.
[8] Noel, J.P.; Jez, J.M.; Bowman, M.E.; Dixon, R.A., (2000). Structure and Mechanism of the Evolutionarily Unique Plant Enzyme Chalcone Isomerase. Nat. Struct. Biol. 7, 786–791.
[9] CROFT, K.D., (1998). The Chemistry and Biological Effects of Flavonoids and Phenolic Acidsa. Ann. N. Y. Acad. Sci. 854, 435–442.
[10] Martens, S.; Mithöfer, A., (2005). Flavones and Flavone Synthases. Phytochemistry, 66, 2399–2407.
[11] Nabavi, S.M.; Šamec, D.; Tomczyk, M.; Milella, L.; Russo, D.; Habtemariam, S.; Suntar, I.; Rastrelli, L.; Daglia, M.; Xiao, J.; et al., (2020). Flavonoid Biosynthetic Pathways in Plants: Versatile Targets for Metabolic Engineering. Biotechnol. Adv, 38, 107316.
[12] Mencherini, T., Picerno, P., Scesa, C., & Aquino, R. (2007). Triterpene, antioxidant, and antimicrobial compounds from Melissa officinalis. Journal of Natural Products, 70(12), 1889–1894.
[13] Selvi, R. B., Swaminathan, A., Chatterjee, S., Shanmugam, M. K., Li, F., Ramakrishnan, G. B., … Kundu, T. K. (2015). Inhibition of p300 lysine acetyltransferase activity by luteolin reduces tumor growth in head and neck squamous cell carcinoma (HNSCC) xenograft mouse model. Oncotarget, 6(41), 43806.
[14] Lin, Y., Shi, R., Wang, X., & Shen, H.‐M. (2008). Luteolin, a flavonoid with potential for cancer prevention and therapy. Current Cancer Drug Targets, 8(7), 634–646.
[15] Wang, L., Lee, I. M., Zhang, S. M., Blumberg, J. B., Buring, J. E., and Sesso, H. D. (2009). Dietary intake of selected flavonols, flavones, and flavonoid-rich foods and risk of cancer in middle-aged and older women. Am. J. Clin. Nutr. 89, 905–912.
[16] Sun, D. W., Zhang, H. D., Mao, L., Mao, C. F., Chen, W., Cui, M., et al. (2015). Luteolin inhibits breast cancer development and progression in vitro and in vivo by suppressing notch signaling and regulating MiRNAs. Cell. Physiol. Biochem. 37, 1693–1711.
[17] Zhang, B. C., Zhang, C. W., Wang, C., Pan, D. F., Xu, T. D., and Li, D. Y. (2016). Luteolin attenuates foam cell formation and apoptosis in Ox-LDL-stimulated macrophages by enhancing autophagy. Cell. Physiol. Biochem. 39, 2065–2076.