Giải Nobel năm 2021 đã được trao cho việc phát hiện ra kênh cảm biến nhiệt động vật TRPV1. Đang chú ý, kênh này có nhiều đặc điểm tương đồng với kênh cảm biến nhiệt ở thực vật CNGC2/4. Cả hai kênh đều phản ứng với những thay đổi do nhiệt độ gây ra cho trạng thái lỏng của màng sinh chất, dẫn đến quá trình phosphoryl hóa quá mức yếu tố phiên mã HSF1 thông qua một tầng tín hiệu nhiệt cụ thể.
Theo Anthony Guihur, Mathieu E. Rebeaud, Baptiste Bourgine, Pierre Goloubinoff (2022). How do humans and plants feel the heat? Trend in Plant Science, 27(7). https://doi.org/10.1016/j.tplants.2022.03.006
Vui lòng ghi rõ nguồn https://cnsh.vnua.edu.vn/ khi đăng lại nội dung này
Giải Nobel Y học và Sinh lý học năm 2021 đã được trao cho David Julius và Ardem Patapoutian vì đã khám phá ra kênh ion cảm nhận nhiệt TRPV1 và thành phần kênh ion nhạy cảm cơ học 2, PIEZO2, ở động vật có xương sống. Trong bối cảnh sự nóng lên toàn cầu trở nên trầm trọng hơn, điều quan trọng là phải có được kiến thức, không chỉ về động vật có xương sống, mà còn về cách thực vật, nấm, động vật nguyên sinh, vi khuẩn và vi khuẩn cổ cảm nhận được những thay đổi đột ngột của nhiệt độ môi trường và phản ứng kịp thời để thiết lập các biện pháp phòng vệ khác nhau để ngăn chặn và khắc phục những thiệt hại từ những điều kiện bất lợi từ môi trường. Một điều khá thú vị là những phát hiện về cảm nhận nhiệt của con người cung cấp manh mối có giá trị về cách thực vật trên cạn có thể cảm nhận tương tự sự gia tăng nhiệt độ môi trường và thiết lập khả năng bảo vệ phân tử tương tự, bằng cách tích lũy một nhóm protein bảo thủ sốc nhiệt (HSP), tạo ra khả năng chịu nhiệt cho cả động vật có xương sống và thực vật [1.].
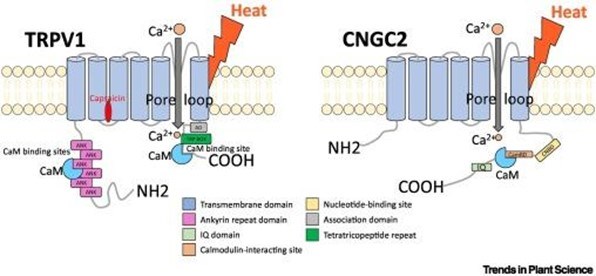
Kênh cảm biến nhiệt của động vật TRPV1 tạo thành một kênh ion tứ thể xuyên màng ở trạng thái phân cực khép kín khi nghỉ ở nhiệt độ thấp, sẵn sàng đáp ứng với sự gia tăng nhiệt độ. Cholesterol là một phân tử làm cứng màng giúp kiểm soát sự chuyển pha của màng ở các nhiệt độ kích hoạt nhiệt (nóng) đối với TRPV1 [2.], cho thấy rằng phản ứng sốc nhiệt phụ thuộc cả vào đặc điểm phản ứng nhiệt nội tại của các kênh, như đã được chứng minh bởi các đột biến nhạy cảm với nhiệt độ [3.], và sự hiện diện của các phân tử, chẳng hạn như cholesterol hoặc lipid bão hòa/không bão hòa ảnh hưởng đến tính lưu động của màng sinh chất mà trong đó các TRPV1 được khảm vào (Hình 1, bên trái). Dưới tác động của sốc nhiệt, kênh TRPV1 mở ra tạm thời và điều hòa sự xâm nhập của các ion Ca2+ ngoại bào, các ion này liên kết, thu hút và kích hoạt các calmodulin liên kết với vùng đầu C và N nội bào của kênh TRPV1 [4.]. Việc này tạo ra một tín hiệu tế bào cụ thể kích hoạt yếu tố phiên mã sốc nhiệt 1 (HSF1). Mô hình được chấp nhận rộng rãi cho tế bào động vật là HSF1 được duy trì ở trạng thái không hoạt động trong tế bào chất bởi các phân tử HSP70 và HSP90 được liên kết, ở nhiệt độ thấp. Khi bị sốc nhiệt, các protein chaperon được quan sát phân ly, trong khi HSF1 đồng thời trở nên phosphoryl hóa quá mức và hoạt động; do đó, người ta thường cho rằng một số protein không bền nhiệt chưa biết, có thể do tích lũy, có thể loại bỏ các yếu tố ức chế HSP70 và HSP90 khỏi phức hợp HSF1. Do đó, HSF1 đã kích hoạt được giải phóng để chuyển vị trí vào nhân, thu hút các RNA polymerase để tổng hợp HSP mRNA [5.]. Do đó, sự tích tụ lớn của HSP, nhiều trong số đó là chaperone phân tử, thiết lập các cơ chế bảo vệ hiệu quả chống lại sự phá hủy nhiệt trong các protein và màng chịu nhiệt.
    |
 |
| Cảm biến nhiệt của động vật và thực vật rất giống nhau về cấu trúc và chức năng |
Tổ chức miền của các kênh cảm nhiệt. Kênh TRPV1 ở động vật có xương sống (trái) và kênh CNGC2 ở thực vật (phải) là các kênh tứ thể trong màng sinh chất. Các tiểu đơn vị của chúng bao gồm sáu vòng xoắn xuyên màng với một vòng lỗ rỗng giữa vòng xoắn 5 và 6. Cả hai kênh liên kết các calmodulin ở đầu C nội bào của chúng. Đầu N của TRPV1 chứa sáu miền ankyrin cũng liên kết với các calmodulin. Nhiệt độ cao hơn làm tăng tính lưu động của màng sinh chất. Điều này, hoặc liên kết capsaicin với TRPV1, gây ra sự mở tạm thời của các kênh và liên kết canxi ngoại bào với các calmodulin liên quan đến kênh ở phía tế bào, từ đó gửi tín hiệu cụ thể để kích hoạt các yếu tố phiên mã sốc nhiệt và tạo ra các protein bảo vệ sốc nhiệt.
Kênh TRPV1 khử cực nhiệt sẽ sớm đóng lại và không tiếp tục cho phép sự di chuyển của các ion Ca2+ bên ngoài, bất chấp sự kích thích nhiệt đang diễn ra. Như đã minh họa cho TRPV3 [6.], cần nhiều giờ ở nhiệt độ không gây sốc để các kênh loại TRPV khôi phục trạng thái phản ứng nhiệt ban đầu, sẵn sàng phản ứng lại với kích thích nhiệt sắp tới. Liên kết của capsaicin có tính kích hoạt thụ thể với TRPV1 gây ra sự hấp thụ nhiệt cục bộ. Việc kích hoạt bằng nhiệt hoặc liên kết của capsaicin ở 37°C đều tạo ra một dạng tích lũy HSP tương tự [7.]. Bởi vì capsaicin là một chất có thể kích hoạt thụ thể đối với TRPV1 mạnh nên nó được sử dụng trong gây mê [8.]. Ngược lại, chứng minh rằng TRPV1 là một trung tâm cảm biến nhiệt của tế bào người, tiền xử lý tế bào với TRPV1 RNAi hoặc capsazepine đối kháng TRPV1 hoặc EGTA chelate hóa Ca2+ bên ngoài, tất cả đều ngăn chặn sự tích tụ HSP do nhiệt gây ra [7.].
Đáng chú ý, thực vật bậc cao cũng chứa các kênh cảm biến nhiệt cụ thể, được gọi là các kênh nucleotide vòng (CNGC2/4s) [9., 10., 11.] (Hình 1, bên phải), giống như TRPV1, hình thành ở các kênh ion xuyên màng ở nhiệt độ thấp ở trạng thái đóng. Trạng thái phân cực khép kín này sẵn sàng đáp ứng với sự gia tăng do nhiệt gây ra trong tính lưu động của màng sinh chất xung quanh. Giống như TRPV1, khi tiếp xúc với nhiệt, các kênh CNGC2/4 phản ứng với nhiệt sẽ mở tạm thời và làm trung gian cho sự xâm nhập có kiểm soát của các ion Ca2+ bên ngoài, các ion này liên kết với các calmodulin được liên kết với đầu C nội bào của kênh [12.]. Điều này kích hoạt một tầng tín hiệu nhiệt cụ thể liên quan đến kinase mà cuối cùng là phosphoryl hóa và kích hoạt HSFA1 [13.].
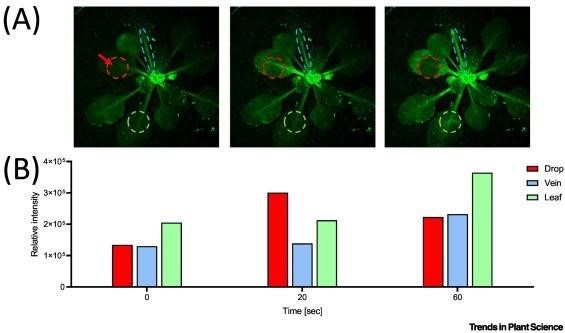
Hơn nữa, giống như tế bào thần kinh, bằng cách tạo ra sự xâm nhập nhanh chóng của ion Ca2+ dọc theo sợi trục, có thể truyền tín hiệu nhiệt từ một cơ quan ở xa đến não người và tạo ra phản ứng trốn thoát, thực vật cũng có thể truyền tín hiệu nhiệt ban đầu từ một chiếc lá được làm nóng đến các lá lân cận, bằng việc khởi tạo mạnh các dòng ion Ca2+ dọc theo hệ mạch [14.]. Đáng chú ý, hệ mạch của thực vật bao gồm cả các tế bào mạch gỗ rỗng đã chết và lưới mạch rây sống(Hình 2). Thật thú vị, giống như các sợi trục ở động vật là phần mở rộng tế bào sống biệt hóa cao được nuôi dưỡng bởi các tế bào thần kinh đệm lân cận, lưới mạch rây là phần mở rộng tế bào sống biệt hóa cao được nuôi dưỡng bởi các tế bào đồng hành. Trong khi đó, các tế bào mạch gỗ chết rỗng thiếu nguồn năng lượng để khởi tạo sự sản sinh mạnh mẽ ion canxi (trong khoảng 20 giây) ngược dòng nước xuống cuống lá của cây arabidopsis (Arabidopsis thaliana) (Hình 1B), về nguyên tắc, lưới mạch rây sống có thể sử dụng năng lượng từ quá trình thủy phân ATP để làm như vậy theo một cơ chế chưa được xác định.
    |
 |
| Ứng suất nhiệt cục bộ tạo ra tín hiệu nhiệt phụ thuộc canxi giữa các lá |
(A) Cây Arabidopsis thaliana chuyển gen biểu hiện một cách liên tục chất phát huỳnh quang GCaMP3 phụ thuộc canxi [15.]. Khoảng thời gian (0, 20 và 60 giây) sau khi nhỏ một giọt nước nóng ở 45°C một chiếc lá (mũi tên đỏ và hình tròn). Các vòng tròn màu xám cho thấy nồng độ canxi cao trong các mô sống của hệ mạch rìa và lá. (B) Các dòng Ca2+ trong khoảng thời gian (tại 0, 20 và 60 giây) ở cường độ tương đối được tính bằng ImageJ bằng cách đo huỳnh quang GFP.
Tuy nhiên, khác với động vật có xương sống có TRPV1 ở não và cơ, tiến hóa có thể đã tạo lợi thế trong việc phát triển khả năng hấp thụ để tránh tổn hại do nhiệt, thực vật có biểu hiện CNGC nhưng thiếu não và cơ. Do đó, mặc dù tương tự như động vật có xương sống, các mô thực vật cảm nhận nhiệt và phản ứng bằng cách tạo ra HSP và bằng cách gửi tín hiệu nhiệt đến các cơ quan lân cận, không giống như động vật, thực vật không di chuyển được. Thực vật không thể tránh tổn hại do nhiệt và do đó, khó có thể xảy ra sự phát triển của kích ứng độc hại như một hệ thống cảnh báo hữu hiệu giúp thực vật tránh tổn hại do nhiệt.
Do đó, mặc dù có sự tương đồng về cảm nhận và các con đường đường dẫn truyền tín hiệu giữa cảm biến nhiệt TRPV1 và cảm biến nhiệt CNGC, nhưng không chắc thực vật có thể cảm nhận nỗiđau. Tuy nhiên, là những sinh vật phức tạp và đóng vai trò là nguồn thức ăn chính cho dân số ngày càng tăng trên hành tinh, thực vật xứng đáng được nghiên cứu thêm để hiểu các đặc điểm chức năng và tiềm năng thích ứng của chúng với sự nóng lên toàn cầu, cũng như thái độ và sự tôn trọng của chúng ta [15.].
Tài liệu trích dẫn
1. Mittler R. et al. How do plants feel the heat? Trends Biochem. Sci. 2012; 37: 118-125.
2. Liu B. et al. Thermodynamics of heat activation of single capsaicin ion channels VR1. Biophys. J. 2003; 85: 2988-3006.
3. Gracheva E.O. et al. Ganglion-specific splicing of TRPV1 underlies infrared sensation in vampire bats. Nature. 2011; 476: 88-91.
4. Lau S.Y. et al. Distinct properties of Ca2+-calmodulin binding to N- and C-terminal regulatory regions of the TRPV1 channel. J. Gen. Physiol. 2012; 140: 541-555.
5. Masser A.E. et al. Hsf1 on a leash - controlling the heat shock response by chaperone titration. Exp. Cell Res. 2020; 396112246.
6. Nadezhdin K.D. et al. Structural mechanism of heat-induced opening of a temperature-sensitive TRP channel. Nat. Struct. Mol. Biol. 2021; 28: 564-572.
7. Bromberg Z. et al. The membrane-associated transient receptor potential vanilloid channel is the central heat shock receptor controlling the cellular heat shock response in epithelial cells. PLoS ONE. 2013; 8e57149.
8. Koivisto A.P. et al. Advances in TRP channel drug discovery: from target validation to clinical studies. Nat. Rev. Drug Discov. 2021; 21: 41-59.
9. Finka A. et al. Plasma membrane cyclic nucleotide gated calcium channels control land plant thermal sensing and acquired thermotolerance. Plant Cell. 2012; 24: 3333-3348.
10. Saidi Y. et al. The heat shock response in moss plants is regulated by specific calcium-permeable channels in the plasma membrane. Plant Cell. 2009; 21: 2829-2843.
11. Jarratt-Barnham E. et al. The complex story of plant cyclic nucleotide-gated channels. Int. J. Mol. Sci. 2021; 22: 874.
12. Fischer C. et al. An IQ domain mediates the interaction with calmodulin in a plant cyclic nucleotide-gated channel. Plant Cell Physiol. 2013; 54: 573-584.
13. Bourgine B. Guihur A. Heat shock signaling in land plants: from plasma membrane sensing to the transcription of small heat shock proteins. Front. Plant Sci. 2021; 12710801.
14. Nguyen C.T. et al. Identification of cell populations necessary for leaf-to-leaf electrical signaling in a wounded plant. Proc. Natl. Acad. Sci. U. S. A. 2018; 115: 10178-10183.
15. Knapp S. Are humans really blind to plants?. Plants People Planet. 2019; 1: 164-168.
Người dịch: Trần Thị Minh Phương - K64CNSHE
Biên tập: Nguyễn Văn Khoa - K64CNSHE